Enlace significa unión, un enlace
químico es la unión de dos o más átomos con un solo fin, alcanzar la
estabilidad. Los enlaces químicos son las fuerzas que mantienen unidos a los átomos.
A continuación se muestra un
esquema de los tipos de enlaces químicos:
1. ENLACE IÓNICO
Por ejemplo el cloruro de sodio es un elemento con enlace iónico:
Na → Na+ + e
Cl + e → Cl-
Ambos átomos se han
convertido en iones:
v Na perdió un electrón, ahora su carga es 1+
v Cl ganó un electrón, ahora su carga es 1-
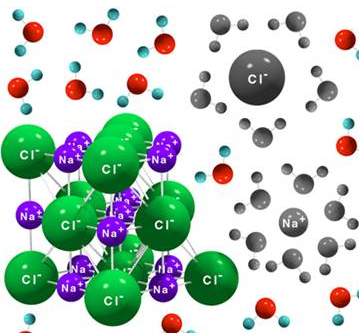
Así, el cloruro de sodio no está formado por moléculas de NaCl ni de Na+Cl -, sino que cada ión se rodea del máximo número posible de iones con carga de signo contrario, originando una red cristalina, eléctricamente neutra.
En conjunto podemos
suponer que la celdilla unidad, que es la porción más pequeña de cristal que
posee todos los elementos de simetría. También se puede considerar que la celda
unidad es un cubo grande dividido en ocho cubos pequeños, estando los iones Cl–
y Na+ ocupando los vértices de estos cubos pequeños, de forma
alternativa.
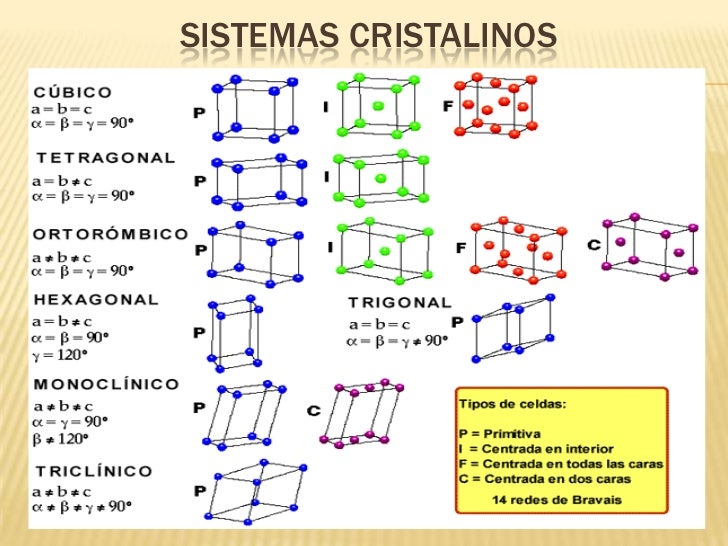
Son compuestos duros pero
quebradizos, porque el enlace iónico es ordenado. En total hay 7 tipos
de redes iónicas o sistemas cristalinos; el que se forme un tipo u otro viene determinado por dos
factores: el tamaño relativo de los iones y la relación entre las cargas
(fórmula del compuesto).

Tienen elevados
puntos de fusión y ebullición, ya que se necesita mucha energía (calor) para
debilitar o romper la red, por lo que a temperatura ambiente son sólidos.
Son duros, aunque
frágiles, o quebradizos, ya que al golpearlos se distorsiona la red, enfrentándose
iones del mismo signo, lo que produce repulsiones entre ellos y se pueden
partir en láminas.

Sólo son solubles en
disolventes polares, como el agua, el alcohol, etc. Cada ion atrae al polo de carga
opuesta del disolvente; si esta fuerza es mayor que las fuerzas atractivas
entre los iones de la red el sólido se disolverá. También se puede justificar
en términos energéticos.
En estado sólido no
conducen la corriente eléctrica, ya que los electrones están fijos, pero sí la
conducen si están fundidos o en disolución, puesto que los iones gozan de libertad
de movimiento y pueden desplazarse atraídos por la carga contraria de un generador.
Esta conducción no es por electrones sino por iones y se llama conducción
electrolítica.

Numerosos compuestos
iónicos al formarse incorporan moléculas de agua a sus iones de la red; en este
caso se llaman hidratos y se nombran igual que los compuestos anhidros (sin
agua) indicando con un prefijo el número de moléculas de agua y la terminación hidratado.
Ejemplos: CuSO4.5
H2O sulfato de cobre (II) pentahidratado.

2. ENLACE COVALENTE
El enlace covalente es la unión que como resultado de la
compartición de uno o más pares de electrones se establece entre dos átomos.
Dos elementos no metálicos
comparten sus electrones. Ninguno de los átomos tiene suficientemente energía
para perder o ganar electrones. El caso más típico es el de dos átomos del
mismo elemento.
Los compuestos covalentes pueden presentarse en cualquier estado de
agregación, sólido líquido o gaseoso. Son malos conductores del calor y la electricidad. Tienen temperaturas de fusión y ebullición relativamente bajos.


A veces, para un
compuesto se pueden proponer varias estructuras de Lewis, por lo que para
deducir su estructura correcta hay que recurrir a los siguientes parámetros moleculares
deducidos experimentalmente:
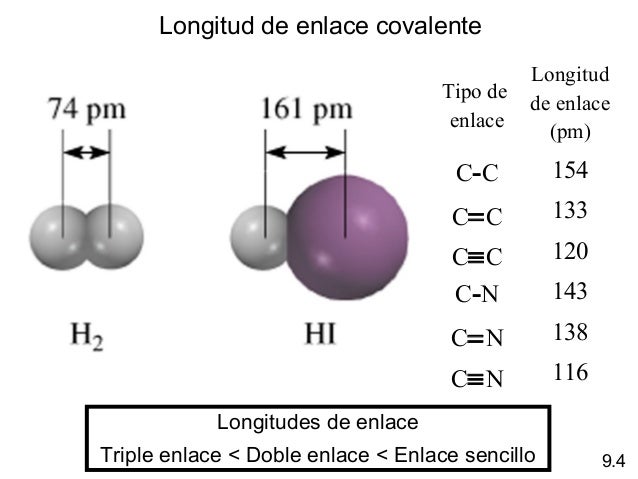
Longitud de enlace es la distancia internuclear en la que el
compuesto es más estable (mínima energía), es decir, la distancia entre los
núcleos de dos átomos unidos por enlace covalente.

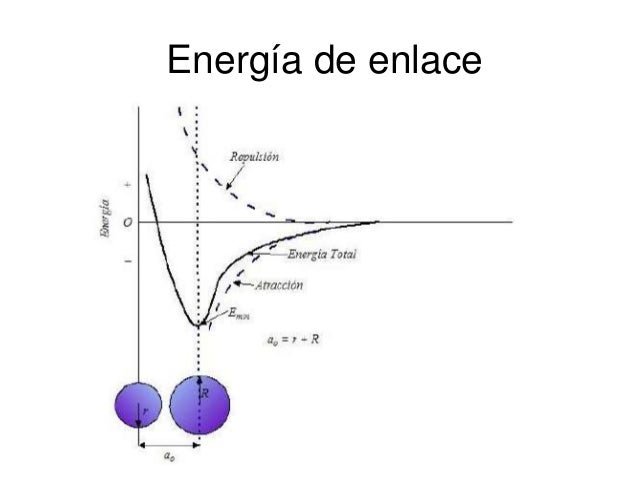
Energía de enlace es la energía desprendida en la formación de
un enlace covalente. Se suele referir a un mol de enlaces y expresar en kJ/mol.
Para romper el enlace formado y separar los átomos a una distancia infinita, es
preciso aportar una energía igual o superior a la energía de enlace. Esta
energía mínima se llama energía de disociación.

Para el hidrógeno (H2),
la longitud de enlace es 0,74 A y la energía de enlace 430 kJ/mol. Lógicamente,
existe una relación entre la longitud de enlace y la fortaleza del mismo: a
menor longitud de enlace, mayor fortaleza.
Orden de enlace es el número de enlaces covalentes que se
forman entre dos átomos. Inicialmente Lewis consideró que siempre sería un
número entero y menor que 4. Más adelante veremos que el orden de enlace puede
ser también un número fraccionario.
Ángulo de enlace es el ángulo formado por las líneas
imaginarias que unen los núcleos de los átomos.

Los enlaces covalentes se pueden clasificar en diferentes clases como se muestran a continuación:
Enlace covalente sencillo:
Sólo se comparte un par de electrones entre los átomos que forman el enlace.
Enlaces múltiples:
Se comparten dos o tres pares de electrones entre los átomos que forman el enlace.
Enlace
Covalente Dativo:
Se produce cuando dos átomos
comparten una pareja de electrones, pero dicha pareja procede solamente de uno
de los átomos combinados.
Enlace
Covalente Polar:
El término polar significa que hay separación de cargas.Un lado del enlace
covalente es más “negativo” que el otro.
MOMENTO DIPOLAR
Un enlace covalente polar posee
una distribución de cargas no homogénea. Esto se debe a que los
átomos que los forman tienen diferente eletronegatividad, por lo
tanto, los dos electrones del enlace son atraídos con distinta fuerza por los
átomos que los comparten.
Los electrones tienden a
estar mayormente en las proximidades del átomo más electronegativo. Aunque se
sigue conservando la neutralidad eléctrica global, el átomo más electronegativo
tiene un predominio de carga negativa mientras que sobre el átomo menos
electronegativo hay un predominio de carga positiva.
Este fenómeno se conoce como
un dipolo. La magnitud de ese dipolo viene definida por lo que se
conoce como momento dipolar (µ) y es
el producto de la carga fraccional o parcial presente sobre cada
átomo por la distancia que las separa. La unidad de momento dipolar
es el debye; 1 D = 3,34 x 10-30 Culombio x m.
A continuación
se muestran algunos valores de la longitud de enlace y sus respectivos
momentos dipolares para una serie de compuestos. Trata de justificar el
comportamiento de estas propiedades.
LONGITUDES DE
ENLACE Y MOMENTO DIPOLAR DE LOS HALOGENUROS DE HIDRÓGENO
|
||
MOLÉCULA
|
LONGITUD DE ENLACE (Å)
|
MOMENTO DIPOLAR (D)
|
HF
|
0,92
|
1,82
|
HCl
|
1,27
|
1,08
|
HBr
|
1,41
|
0,82
|
HI
|
1,61
|
0,44
|
De igual forma explique el comportamiento de las
siguientes propiedades en grupo de compuestos.
MOMENTOS DIPOLARES
DE VARIAS MOLÉCULAS EN FASE GASEOSA
|
||
MOLÉCULA
|
∆ ELECTRONEGATIVIDAD
|
MOMENTO DIPOLAR (D)
|
Cl2
|
0
|
0
|
ClF
|
1,0
|
0,88
|
HF
|
1,9
|
1,82
|
LiF
|
3,0
|
6,33
|
En la siguiente
imagen se ilustra una secuencia de en la diferencia de electronegatividades en
un enlace que puede originar un enlace covalente hasta uno iónico.
Se debe considerar la geometria de la molécula para saber si es polar o no. Por ejemplo, el CO2 no es polar (µ = 0), ya que por tener una estructura lineal, sus dipolos se anulan entre sí por ser de igual magnitud, pero sentidos opuestos. El agua tiene un momento dipolar (µ = 1,84D) por tener geometría angular y dipolos que no se cancelan.
Formación de un enlace covalente puro hasta uno iónico pasando por el covante polar:
Según Pauling, a un enlace se le puede asignar un porcentaje de ionicidad. Ésto permite establecer una escala para definir el el carácter iónico del enlace. En este sentido, un enlace será iónico cuando alcanza más del 50% en su caráter iónico, porcentaje que se logra cuando la diferencia de electronegatividades es superior al 1,7.
DIFERENCIA DE
ELECTRONEGATIVIDAD
|
TIPOS DE ENLACE
|
Menor o igual a 0,4
|
Covalente no polar
|
mayor a 0,4 a 1,7
|
Covalente polar
|
Mayor de 1,7
|
Iónico
|
3. ENLACE METÁLICO
Los átomos metálicos
típicamente tienen electrones de valencia que se encuentran ligados débilmente
a sus núcleos (energías de ionización
pequeñas). A continuación se muestra un modelo para este tipo de enlace conocido como mar de electrones.
De esta manera pueden
deslocalizarse formando un mar de electrones, donde se encuentran sumergidos
los cores (kernels) de los átomos metálicos. Es decir de iones positivos.
El hecho de que la mayoría
de los metales sean sólido y tengan, en
general, altas temperaturas de fusión; implica que el enlace entre ellos es
fuerte. También explica la manera en
que los átomos metálicos están unidos en un metal o una aleación.

Además, dado que el enlace
metálico es no polar o muy poco polar (las diferencias de electronegatividad
entre los metales son muy pequeñas y garantizan esto.)Los electrones no tienen
preferencia por ninguno de los átomos de la red, por tanto se deslocalizan a lo largo de toda
la estructura cristalina del metal.
Este tipo de enlace explica
la mayoría de las propiedades de los metales. Tiene elevadas temperaturas de fusión y ebullición. Son
insolubles en agua. Conducen la electricidad incluso en estado sólido (sólo se
calientan: cambio físico). La conductividad es mayor a bajas temperaturas. Pueden
deformarse sin romperse. A partir de la propiedades de un compuesto sólido se puede identificar el tipo de enlace químico que lo constituye.
















Muy buenos datos bien especificados.
ResponderBorrar--------------------------------
Realizo prueba de esterilidad en microbiología