Fuerzas fundamentales son aquellas fuerzas del Universo que no se pueden
explicar en función de otras más básicas. Las fuerzas o interacciones
fundamentales conocidas hasta ahora son cuatro: gravitatoria, electromagnética,
nuclear fuerte y nuclear débil.


1. La gravitatoria es la fuerza de atracción que un trozo de materia ejerce sobre otro, y afecta a todos los cuerpos. La gravedad es una fuerza muy débil y de un sólo sentido, pero de alcance infinito.

2. La fuerza electromagnética afecta a los cuerpos eléctricamente cargados, y es la fuerza involucrada en las transformaciones físicas y químicas de átomos y moléculas. Es mucho más intensa que la fuerza gravitatoria, tiene dos sentidos (positivo y negativo) y su alcance es infinito.

3. La fuerza o interacción nuclear fuerte es la que mantiene unidos los componentes de los núcleos atómicos, y actúa indistintamente entre dos nucleones cualesquiera, protones o neutrones. Su alcance es del orden de las dimensiones nucleares, pero es más intensa que la fuerza electromagnética.
4. La fuerza o interacción nuclear débil es la responsable de la desintegración beta de los neutrones; los neutrinos son sensibles únicamente a este tipo de interacción. Su intensidad es menor que la de la fuerza electromagnética y su alcance es aún menor que el de la interacción nuclear fuerte.

Las partículas fundamentales interaccionan electromagnéticamente
mediante el intercambio entre partículas cargadas.
Dentro de una molécula, los
átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos,
metálicos o covalentes). Estas son las fuerzas que se deben
vencer para que se produzca un cambio químico. Son estas fuerzas, por tanto,
las que determinan las propiedades químicas de las sustancias.
Sin embargo, existen otras fuerzas
intermoleculares que actúan sobre distintas moléculas o iones y que hacen
que éstos se atraigan o se repelan. Estas fuerzas son las que determinan
las propiedades físicas de las sustancias como, por ejemplo, el estado de
agregación, la temperatura de fusión y de ebullición, la solubilidad, la tensión
superficial, la densidad, entre otras.
Por
lo general, son fuerzas débiles pero, al ser muy numerosas, su contribución es
importante. La figura inferior resume los diversos tipos de fuerzas
intermoleculares.
1. FUERZAS DE DISPERSIÓN
También se llaman fuerzas de London. Las fuerzas de dispersión son fuerzas
atractivas débiles que se establecen fundamentalmente entre sustancias no
polares, aunque también están presentes en las sustancias polares. Se deben a
las irregularidades que se producen en la nube electrónica de los átomos de las
moléculas por efecto de la proximidad mutua.
La formación de un dipolo
instantáneo en una molécula origina la formación de un dipolo
inducido en una molécula vecina de manera que se origina una débil fuerza
de atracción entre las dos.
Estas fuerzas son
mayores al aumentar el tamaño y la asimetría de las moléculas. Son mínimas en
los gases nobles (He, Ne), algo mayores en los gases diatómicos (H2,
N2, O2) y mayores aún en los gases poliatómicos (O3,
CO2).
Por lo tanto, la polarizabilidad es
la medida de la capacidad de distorsión de la nube electrónica, dentro de un átomo
o molécula, originando la formación de un dipolo momentáneo.
2. FUERZAS DIPOLO-DIPOLO
Una molécula es un dipolo cuando
existe una distribución asimétrica de los electrones debido a que la
molécula está formada por átomos de distinta electronegatividad. Como
consecuencia de ello, los electrones se encuentran preferentemente en las
proximidades del átomo más electronegativo. Se crean así dos regiones (o polos)
en la molécula, una con carga parcial negativa y otra con carga parcial
positiva.
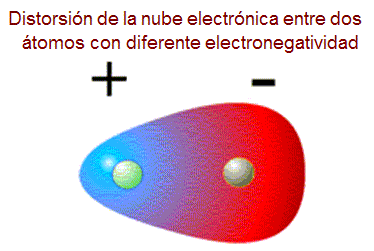
Cuando dos moléculas polares
(dipolos) se aproximan, se produce una atracción entre el polo positivo de una
de ellas y el negativo de la otra. Esta fuerza de atracción entre dos dipolos
es tanto más intensa cuanto mayor es la polarización de dichas moléculas
polares o, dicho de otra forma, cuanto mayor sea la diferencia de
electronegatividad entre los átomos enlazados.

Los enlaces serán tanto más
polares cuanto mayor sea la diferencia de electronegatividad entre los átomos
enlazados.
3. FUERZAS TIPO PUENTE DE HIDRÓGENO
Los puentes de hidrógeno
constituyen un caso especial de interacción dipolo-dipolo. Se producen cuando
un átomo de hidrógeno está unido covalentemente a un elemento que sea:
·
Electronegatividad alta y con pares de
electrones libres.
·
Con un pequeño tamaño y capaz, por lo tanto,
de aproximarse al núcleo del hidrógeno.
Estas condiciones se cumplen
en el caso de los átomos de F, O y N.
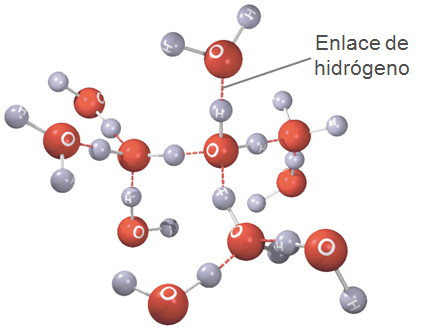
El enlace que forman con el
hidrógeno es muy polar y el átomo de hidrógeno es un centro de cargas positivas
que será atraído hacia los pares de electrones sin compartir de los átomos
electronegativos de otras moléculas. Se trata de un enlace débil (entre
2 y 10 Kcal/mol). Sin embargo, como son muy abundantes, su contribución a la
cohesión entre biomoléculas es grande.
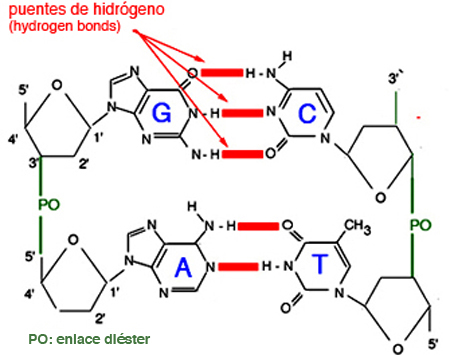

La distancia entre los
átomos electronegativos unidos mediante un puente de hidrógeno suele ser de
unos 3 Å. El hidrógeno se sitúa a 1Å del átomo al que está covalentemente
unido y a 2 Å del que cede sus electrones no apareados.
Muchas de las
propiedades físicas y químicas del agua se deben a los puentes de hidrógeno. Cada
molécula de agua es capaz de formar 4 puentes de hidrógeno, lo que explica
su elevado punto de ebullición, ya que es necesario romper gran cantidad de
puentes de hidrógeno para que una molécula de agua pase al estado gaseoso.

4. FUERZAS ION-DIPOLO
Son las que se establecen entre
un ión y una molécula polar.
Por ejemplo, el NaCl se
disuelve en agua por la atracción que existe entre los iones Na+ y
Cl- y los correspondientes polos con carga opuesta de la
molécula de agua. Esta solvatación de los iones es capaz de vencer
las fuerzas que los mantienen juntos en el estado sólido.

La capa de agua de
hidratación que se forma en torno a ciertas proteínas y que resulta tan
importante para su función también se forma gracias a estas interacciones.
Como se observa en la
gráfica, los puntos de ebullición del HF, H2O y NH3 son más altos de lo esperado, según la tendencia observada en las combinaciones del hidrógeno con
los elementos de los diversos grupos.
Esto es debido a que, en estos casos, se forman asociaciones moleculares, a causa del enlace por puente de hidrógeno, que es necesario romper para provocar el cambio de estado; por eso, las temperaturas de fusión y ebullición resultan más elevadas.
Esto es debido a que, en estos casos, se forman asociaciones moleculares, a causa del enlace por puente de hidrógeno, que es necesario romper para provocar el cambio de estado; por eso, las temperaturas de fusión y ebullición resultan más elevadas.

¿Existen
fuerzas intermoleculares en una sustancia iónica? ¿Qué fuerzas hay que vencer para fundir y
eventualmente llevar al estado gaseoso los cristales de una sustancia iónica?
¿Podría explicar por qué el formaldehído (H2CO) es soluble en agua
mientras que el metano (CH4)
no lo es?
La fuerzas intermoleculares que unen a las moléculas de formaldehído son
más semejantes a las que unen a las moléculas de agua, ya que es una molécula
polar. Esto ya determinaría que fuera más soluble que el metano. Pero además, el
formaldehído puede formar uniones puente hidrógeno con el agua, entre el
oxígeno del formaldehído y el hidrógeno del agua, lo que lo hace más soluble
todavía.



Super útil de verdad ;)
ResponderBorrarMe alegra que le haya servido.
ResponderBorrarGracias :)
ResponderBorrartienes bibliografías ? Sería excelente!
ResponderBorrarCordial saludo. Como puede ver en el apartado de referencias, se encuentran los textos y páginas de internet de las cuales se ha tomada la información.
BorrarPregunta, el proceso de Sublimación del I, o el proceso de fusión de un trozo de Al se debe a que se vencen las fuerzas intermoleculares o pq se rompen enlaces covalentes?
ResponderBorrarMuy útil
ResponderBorrargracias
Muy buena información.
ResponderBorrar---------------------------------
Realizo prueba de esterilidad en microbiología